testXpert为完美解决方案,可帮助您满足FDA 21第11部分的要求
- 医药行业对软件有不断增长的要求,要求能记录已完成操作的可追溯性。
- testXpert III配备可追溯性选项,能记录下试验前、试验中和试验后的所有操作和改动,使测试结果和文档可追溯,保护其不发生人为改动。
- 全面的用户管理功能诸如电子记录和电子签名确保测试结果不被篡改。
- 除了符合一些公司内部的组织措施和程序指导,还符合FDA的21 CFR第11部分的要求。
- ZwickRoell还提供鉴定服务包(DQ/IQ/OQ)用于校验工作。
- testXpert III记录所有试验和系统相关的操作和设置,因此总是能回答
“谁在什么时候做了什么,原因是什么,以及谁是负责人?”
电子记录
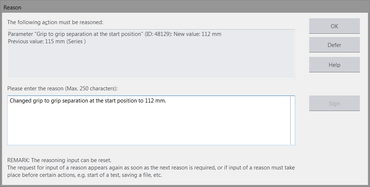
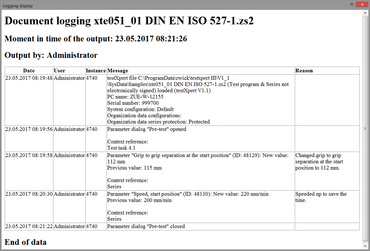
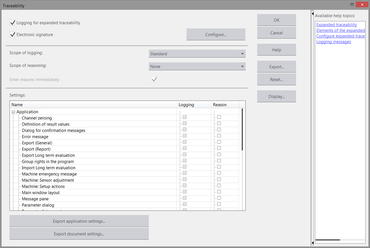
电子记录功能可以完整地记录testXpert III中执行的所有操作和更改,且可防篡改。用户可定义软件必须记录哪些操作,并要求用户根据其规定解释一些操作的原因(例如修改试验相关的参数,诸如试验速度)。这些数据保存在审查追踪中。
- 记录的条目会自动保存,而且与系统审查追踪或各自测试程序/试验系列中的类型单独保存。
- 数据以二进制编码的形式保存且无法用Windows标准程序编写。
- 输出可在任意时间用testXpert III生成为“可读”形式(HTML / PDF)。
- 记录的数据以加密形式存档。
- 修改数据时填写的原因自动添加到独立的报告输入项中(同时显示原数据和修改过的数据)。
- 可通过菜单项在审查追踪中插入注释。