FDA 21 CFR Part 11: Traçabilité et fiabilité des résultats d'essais avec testXpert
La règlementation FDA 21 CFR Part 11 (Code of Federal Regulations) sur les "Enregistrements électroniques et signatures électroniques" de la Food and Drug Administration (FDA) américaine définit les critères d'acceptation pour l'utilisation des enregistrements électroniques et signatures électroniques en remplacement des signatures manuscrites sur un document papier. Le 21 CFR Part 11 garantit ainsi l'authenticité, la fiabilité et la confidentialité des enregistrements électroniques et de leurs signatures ainsi que leur équivalence avec les versions papier et leurs signatures manuscrites.
La conformité avec la FDA 21 CFR Part 11 et l'annexe 11 des directives GMP Europe sera notamment requise, en environnement réglementé, si vous optez pour l’enregistrement électronique et l'utilisation de signatures numériques. L'utilisation de signatures manuscrites sur un document papier demeure néanmoins possible.
Le logiciel d’essai testXpert offre la solution idéale pour répondre aux exigences de la FDA 21 Part 11
- Un dispositif de traçabilité répondant aux exigences réglementaires des industries pharmaceutiques et médicales est intégré à testXpert II.
- Pour garantir la traçabilité de vos résultats et les protéger d'éventuelles manipulations, l'option "Traçabilité" de testXpert III permet la documentation et modification des actions avant, pendant et après l'essai.
- Associées à la "Gestion utilisateur intégrée", les options "Enregistrement électronique" et "Signature électronique" offrent tous les outils nécessaires à la protection de vos résultats d'essais d'éventuelles manipulation.
- Les procédures organisationnelles spécifiques à chaque entreprise et exigences réglementaires de la FDA in 21 CFR Part 11 sont respectées.
- ZwickRoell propose également un Pack Service Qualification (DQ/IQ/OQ) pour accompagnement à la validation.
- testXpert III rapporte toutes les actions et réglages d'importance systémique pour l'essai et le système et répond ainsi à tout moment à la question
„Qui fait quoi, quand, pourquoi et qui est responsable?“
Essais de sécurité
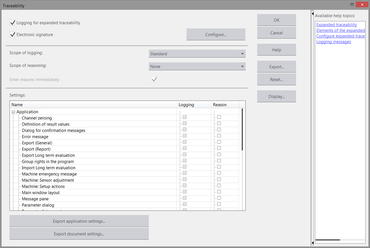
L'option „Traçabilité“ est librement configurable. Vous pouvez également y prescrire le niveau de traçabilité souhaité. L'organisme responsable définit quels sont les éléments à documenter ainsi que les justifications qui devront être fournies par l'utilisateur pour les différents processus et événements. S'adapter aux directives QS spécifiques à l'environnement du client est l'une des fonctionnalités de testXpert III.
Marquage électronique
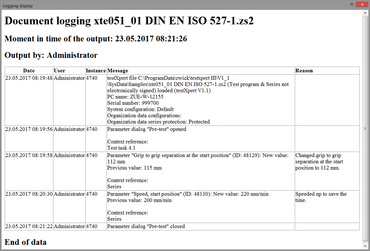
La fonction „Marquages électroniques“ permet une documentation complète non manipulable de toutes les actions et modifications effectuées dans testXpert III. L'utilisateur définit, en fonction de ses exigences réglementaires, le degré des actions à documenter et à éventuellement justifier (par exemple, modification apportée à un paramètre d'essai important tel que la vitesse d'essai). Le système enregistre ensuite ces données dans un fichier journal (Audit-Trail).
- Le système stocke automatiquement les entrées du journal et les enregistre, selon leur type, dans le System-Audit-Trail et/ou dans la spécification d'essai/série d'essai correspondante.
- Les données binaires, ainsi conservées, deviennent dès lors quasiment indéchiffrables avec un programme Windows standard.
- Une sortie dans un format „lisible“ (HTML / PDF) pourra toutefois être effectuée à tout moment à partir de testXpert III.
- L'archivage des données du journal est chiffré.
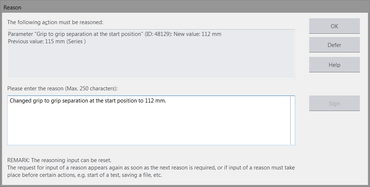
- Une justification facultative est ajoutée automatiquement à l'entrée de PV correspondante (avec l'ancienne valeur ainsi que la valeur modifiée).
- Un commentaire libre peut être ajouté dans l'Audit-Trail via un point de menu.
Signature électronique
La fonction „Signature électronique“ protège fiablement les spécifications d'essais/séries d'essais de modifications non-souhaitées. En remplaçant la signature sur le rapport d'essai par une une signature numérique de la spécification d'essai/série (au moyen de l'identifiant et du mot de passe utilisateur dans testXpert III), la fonction „Signature électronique“ permet une cession documentée de la responsabilité ainsi que le passage à une „documentation sans papier“. Cela permet de déterminer précisément le nombre de signataires de même que les utilisateurs autorisés à signer. Le système protège la spécification d'essai et série, signées, de modifications non-autorisées.
Qualification des machines d'essais des matériaux et appareils
L'examen technique des installations et équipements individuels constitue un aspect essentiel de la validation des processus dans l'industrie médicale et pharmaceutique. Cette qualification est également requise pour les systèmes d'essais des matériaux ZwickRoell, utilisés dans les industries médicales et pharmaceutiques; ces derniers étant soumis à différentes exigences légales (par exemple, selon la Directive Dispositifs médicaux 93/42/CE ou spécifications telles que FDA 21 CFR Part 11).
ZwickRoell vous accompagne, dans la qualification de votre systèmes d'essais ZwickRoell, dans les étapes de la DQ (qualification de conception), IQ (qualification d'installation) et OQ (qualification de mise en œuvre) sous la forme d'une documentation de qualification complète et personnalisée ainsi que dans la mise en œuvre pratique de la qualification sur site.