FDA 21 CFR Parte 11: Risultati di prova tracciabili, a prova di manomissione con testXpert
Il regolamento FDA 21 CFR Parte 11 (Code of Federal Regulations) in materia di record elettronici e firme elettroniche sotto la giurisdizione del Food and Drug Administration (FDA) degli Stati Uniti stabilisce i requisiti per garantire che i record elettronici e le firme siano sostituti affidabili ed equivalenti dei record cartacei e delle firme manoscritte. Questi documenti elettronici devono essere trattati con la stessa riservatezza, essere altrettanto autorevoli e avere lo stesso valore dei documenti cartacei.
Per l'uso di registri e firme elettroniche in un ambiente regolamentato, è richiesta la conformità alle regolamentazioni FDA 21 CFR Parte 11 e alle linee guida GMP dell'UE, allegato 11. L'utilizzo di documenti cartacei tradizionali e di firme autografe rimane un'opzione.
testXpert è la soluzione perfetta per aiutarti a soddisfare i requisiti FDA 21 Parte 11
- Richieste sempre crescenti vengono poste sul software utilizzato nell’industria medicale e farmaceutica, per quanto concerne la tracciabilità delle azioni completate.
- Con l'opzione della tracciabilità, il testXpert III consente di registrare tutte le azioni e le modifiche prima, durante e dopo la prova, rendendo i risultati e la documentazione tracciabili e proteggendoli da manipolazioni.
- La gestione integrata di utenti e funzioni quali la registrazione e la firma elettronica assicurano risultati di prova sempre protetti da eventuali manomissioni.
- Unitamente alle misure organizzative e alle procedure che si applicano alle singole società, i requisiti della FDA in 21 CFR Parte 11 sono rispettati.
- ZwickRoell offre anche un pacchetto di servizi di qualificazione (DQ/IQ/OQ) come supporto alla convalida.
- testXpert III registra tutte le azioni e le impostazioni relative alla prova e al sistema e per questo è sempre in grado di rispondere alla domanda:
"Chi fa cosa, quando, perché e chi è il responsabile?”
Test critici per la sicurezza
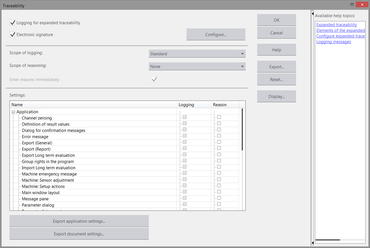
L'opzione di tracciabilità espansa è configurabile liberamente, è inoltre possibile predefinire il grado di tracciabilità. L'amministratore può decidere quali azioni devono essere registrate e per quali azioni o eventi deve essere inserita una ragione. A questo scopo, testXpert III offre la possibilità di adattarsi individualmente alle direttive QS specifiche per l'ambiente del cliente.
Monitoraggio del livello elettronico
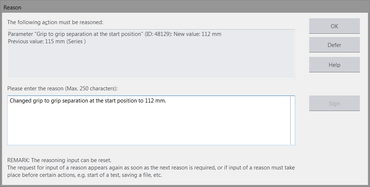
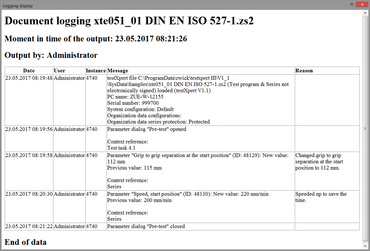
La funzione di monitoraggio del livello elettronico fornisce la documentazione completa e a prova di manomissione relativa a tutte le azioni e modifiche eseguite nel tesXpert III. Gli utenti definiscono, in base ai loro requisiti normativi, il grado di registrazione e la giustificazione delle azioni (per esempio le modifiche di un parametro rilevante per il test come la velocità). Questi dati sono memorizzati nel file di protocollo (Audit-Trail).
- Le voci dei report vengono salvate automaticamente e indipendentemente dal tipo nell'audit trail del sistema o nei rispettivi programmi/serie di prova
- I dati vengono salvati in codifica binaria e non possono essere modificati con i programmi standard di Windows
- I dati possono essere generati nel testXpert III in qualsiasi momento in forma "leggibile" (HTML / PDF)
- I dati registrati vengono archiviati in forma criptata
- La motivazione opzionale viene aggiunta automaticamente al rispettivo input del report (con il valore precedente e con quello modificato)
- I commenti possono essere inseriti all'audit-Trail tramite una voce di menu.
Firma elettronica
La funzione di firma elettronica protegge in modo affidabile il programma/serie di prova da modifiche indesiderate. In questo modo è possibile documentare chi si assume la responsabilità e, allo stesso tempo, rendere l’audit-trail non cartaceo. La firma sul report di prova può essere sostituita dalla firma digitale del programma/serie di prova inserendo il nome utente e la password nel software, è possibile definire quante persone devono firmare e chi è autorizzato a farlo. Una volta firmato, il programma di prova e le serie sono protetti da modifiche non autorizzate.
Qualifica delle macchine e dei dispositivi di prova materiali
Un elemento significativo della convalida dei processi nelle industrie medicali e farmaceutiche è la revisione tecnica dei singoli impianti e dispositivi. Questa qualifica viene applicata anche ai sistemi di prova ZwickRoell usati in questi settori, soggetti a vari requisiti legali (per esempio Direttiva Dispositivi Medicali 93/42/EEC o regolamentazioni come FDA 21 CFR Parte 11).
ZwickRoell sostiene la qualifica dei sistemi di prova materiali nei processi DQ (design qualification), IQ (installation qualification), e OQ (operational qualification) offrendo una documentazione di qualifica completa e, se richiesto, personalizzata, così come nella realizzazione pratica della qualifica in loco.