FDA 21 CFR parte 11: Trazabilidad y protección de los resultados de ensayo con testXpert
La norma FDA 21 CFR parte 11 (Code of Federal Regulations) sobre «Registros electrónicos y firmas electrónicas» de la autoridad sanitaria americana FDA (Food and Drug Administration) define los criterios aceptación del uso de registros electrónicos (electronic records) y firmas electrónicas (electronic signatures) en lugar de registros en papel y firmas a mano. Para ello, esta documentación electrónica deben tener la misma confidencialidad, fiabilidad y equivalencia que los documentos en papel utilizados hasta ahora.
El cumplimiento de las normas FDA 21 CFR parte 11 y la directiva EU GMP anexo 11 es obligatorio en el caso de utilizar registros y firmas electrónicas en un entorno regulado. Sigue estando permitido el uso de documentación tradicional en papel y de firmas manuscritas.
El software de ensayos testXpert ofrece la solución ideal para el cumplimiento de la FDA 21 Parte 11
- Especialmente en la industria farmacéutica y la ingeniería médica, aumentan cada vez más las exigencias en el software empleado, que documenta la trazabilidad de las acciones realizadas.
- Con la opción «Trazabilidad», testXpert III permite registrar todas las acciones y modificaciones -antes, durante y después del ensayo- para garantizar la trazabilidad de los resultados del ensayo y la documentación y, así, protegerlos de cualquier manipulación.
- La «administración de usuarios» integrada y las funciones como «Registros electrónicos» y «Firma electrónica» aseguran que los resultados del ensayo están siempre protegidos de cualquier manipulación.
- Junto con las medidas organizativas y las instrucciones de procedimiento de cada empresa, se cumplirán los requisitos exigidos por la FDA en 21 CFR Parte 11.
- De forma complementaria, ZwickRoell ofrece un paquete de servicios de calificación (DQ/IQ/OQ) de ayuda para la validación.
- testXpert III registra todas las actividades relevantes del ensayo y del sistema y nos facilita continuamente respuestas a la pregunta
«Quién hace cuándo, qué, por qué y quién es responsable?»
Ensayos críticos en términos de seguridad
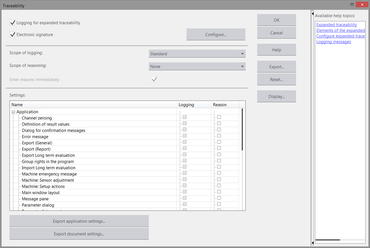
La opción "Trazabilidad" se puede configurar libremente. También se puede predefinir el grado de la trazabilidad. La autoridad responsable determina que se debe incluir en el informe y para qué procesos y eventos el usuario debe introducir argumentos. Para ello, testXpert III ofrece la opción de adaptarse individualmente a las reglas de control de calidad en el entorno del cliente.
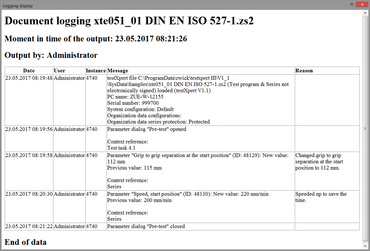
Registros electrónicos
La función "Registros electrónicos" permite generar una documentación completa, no manipulable de todas las acciones y modificaciones realizadas en testXpert III. El usuario define, según sus estándares regulatorios, el grado de protocolización y justificación de las acciones (p. ej. modificación de un parámetros relevante para el ensayo como la velocidad). Dichos datos se guardan en el archivo de protocolo(Audit-Trail).
- Las entradas del protocolo se guardan automáticamente y según el tipo de sistema de auditoría (Audit-Trail) o del programa /serie de ensayo en cuestión.
- Los datos se guardan de forma binaria y no se pueden modificar con programas estándar de Windows.
- Se puede extraer un archivo en formato "legible" (HTML / PDF) desde testXpert III.
- Los datos de protocolo se archivan codificados.
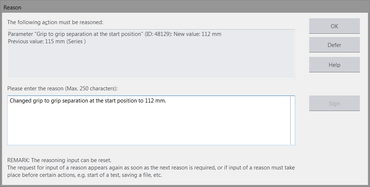
- El argumento opcional se añadirá automáticamente con cada entrada de protocolo (con el valor antiguo y el modificado).
- A través de un punto de menú se puede añadir un comentario en el Audit-Trail.
Firma electrónica
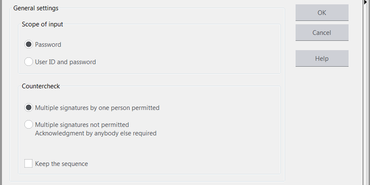
La función "Firma electrónica" protege el programa/ la serie de ensayo de forma segura ante modificaciones indeseadas. Permite la asunción documentada de la responsabilidad y, con ello, también el cambio a una "documentación sin soporte papel". La firma del informe de ensayos se puede sustituir por una firma digital del programa o la serie de ensayos, a través de la identificación de usuario y de la contraseña en el software de ensayos. Se puede definir exactamente cuántas personas firman y quién está autorizado. El programa de ensayo y la serie de ensayo están protegidos contra accesos no autorizados.
Calificación de máquinas y equipos de ensayos de materiales
Una parte fundamental de la validación de procesos en la industria médica y farmacéutica es la verificación técnica de los diferentes equipos y dispositivos. Dicha calificación también es necesaria para aquellos equipos de ensayos de materiales ZwickRoell empleados en las industrias médica y farmacéutica, ya que deben cumplir distintos requisitos legales (p. ej. según la Directiva de productos sanitarios 93/42/CEE o normas como la FDA 21 CFR Parte 11).
ZwickRoell le ofrece asistencia en la calificación de los sistemas de ensayos de la marca ZwickRoell en los apartados DQ (Calificación de diseño), IQ (Calificación de instalación) y OQ (Calificación de operación) en forma de documentación de calificación completa y adaptada a sus necesidades individuales, así como la ejecución de la calificación in situ.